AHM 细胞微球组装与3D打印结合的新策略
- Categories:Innovation News
- Author:
- Origin:
- Time of issue:2020-10-09
- Views:0
(Summary description)大尺度复杂组织的体外构建存在着包括高活性的细胞扩增,大尺度结构的快速、精确制备,以及合适的细胞微环境等挑战。清华大学医学院的杜亚楠课题组近期在Advanced Healthcare Materials期刊上发表了“TGase‐Enhanced Microtissue Assembly in 3D‐Printed‐Template‐Scaffold (3D‐MAPS) for Large Tissu
AHM 细胞微球组装与3D打印结合的新策略
(Summary description)大尺度复杂组织的体外构建存在着包括高活性的细胞扩增,大尺度结构的快速、精确制备,以及合适的细胞微环境等挑战。清华大学医学院的杜亚楠课题组近期在Advanced Healthcare Materials期刊上发表了“TGase‐Enhanced Microtissue Assembly in 3D‐Printed‐Template‐Scaffold (3D‐MAPS) for Large Tissu
- Categories:Innovation News
- Author:
- Origin:
- Time of issue:2020-10-09
- Views:0

大尺度复杂组织的体外构建存在着包括高活性的细胞扩增,大尺度结构的快速、精确制备,以及合适的细胞微环境等挑战。清华大学医学院的杜亚楠课题组近期在Advanced Healthcare Materials期刊上发表了“TGase‐Enhanced Microtissue Assembly in 3D‐Printed‐Template‐Scaffold (3D‐MAPS) for Large Tissue Defect Reparation.”的文章,通过在3D打印的聚合物支架中组装载细胞微球的方法,成功构建了大尺度的耳朵和鼻子等组织结构。

构建策略
“自下而上”的组织工程方法和3D生物打印技术,通过组装或打印含细胞/生物材料的模块或墨水,为大尺度复杂组织的体外构建提供了有力的方法。然而,仍然存在包括高活性的细胞扩增,如何快速、精确制备大尺度结构,以及保持合适的细胞微环境等挑战。另外,缺乏来自内源性血管的长入极大限制了构建的组织在体内的存活和功能。因此,本研究提出了一种将“自下而上”的模块化组装技术(Modular assembly)与3D打印相结合的策略,通过在3D打印的空心聚合物支架(如鼻子或耳状结构)中组装载细胞微球,来实现快速构建大尺度功能化组织的目标。
作者将该策略称为3D打印支架中的微组织组装(Microtissue Assembly in 3D-Printed-template Scaffold, 简称3D-MAPS),其优势在于将3D打印高精度支架,和细胞微球的快速扩增、组装以及其为细胞提供优异微环境等优点结合在一起。在此过程中,引入了转谷氨酰胺酶(TGase)作为酶促交联剂,来促进微组织的粘合和快速融合。此外,基于皮瓣预制(flap prefabrication)方法,将预先设计的宿主血管嵌入到支架中来诱导宿主血管向支架内的长入,能够促进移植后组织的活性和修复治疗效果。本研究使用人间充质干细胞(MSCs),其在包括软骨和骨缺损在内的各种退化性疾病的再生治疗中已得到广泛认可。
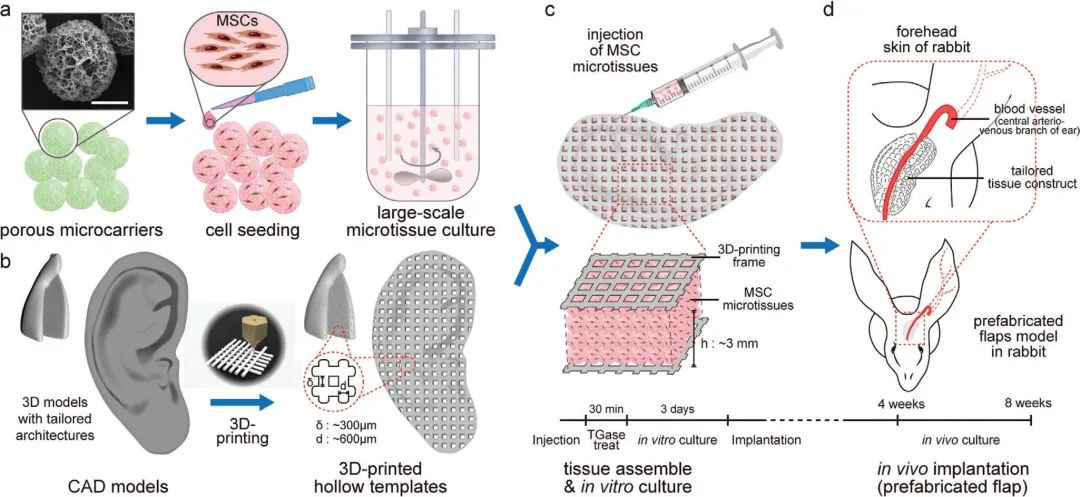
图1. 构建策略
体外MSC细胞良好增殖
大规模构建载MSC细胞的明胶微球,并使用旋转瓶培养装置,可以实现多达2 × 106个微组织的同时培养,培养4天后MSC细胞从5 × 106扩增到9.1× 107个,同时细胞活性高达95%;细胞流式分析显示MSC细胞仍保持其免疫表型,高表达CD73, CD90, CD105,同时低表达CD11b, CD14, CD19, CD34和HLA-DR;通过2 mg mL−1浓度的TGase处理30分钟,可以促进结构稳定性,同时促进MSC细胞的增殖和ECM分泌。
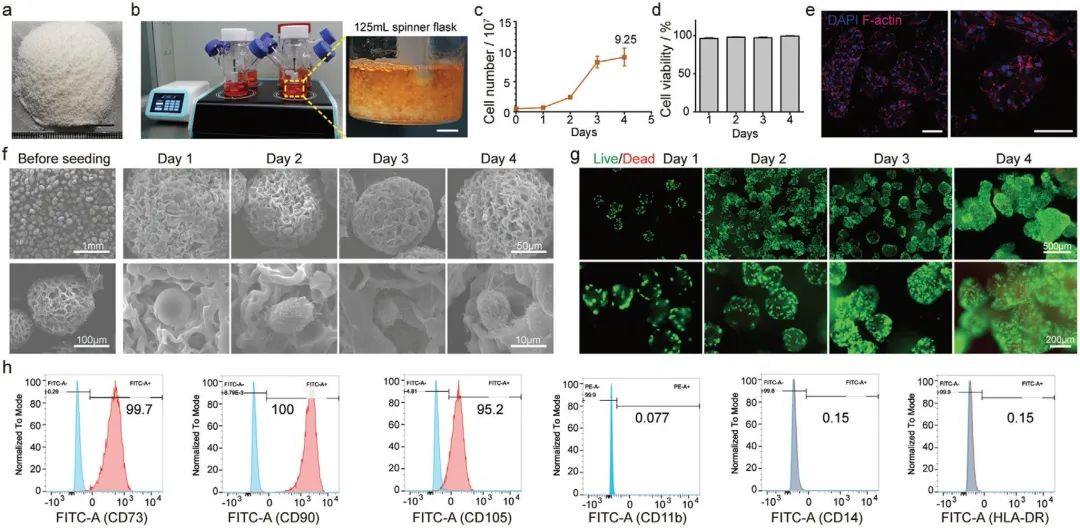
图2 载MSC细胞微球的体外培养
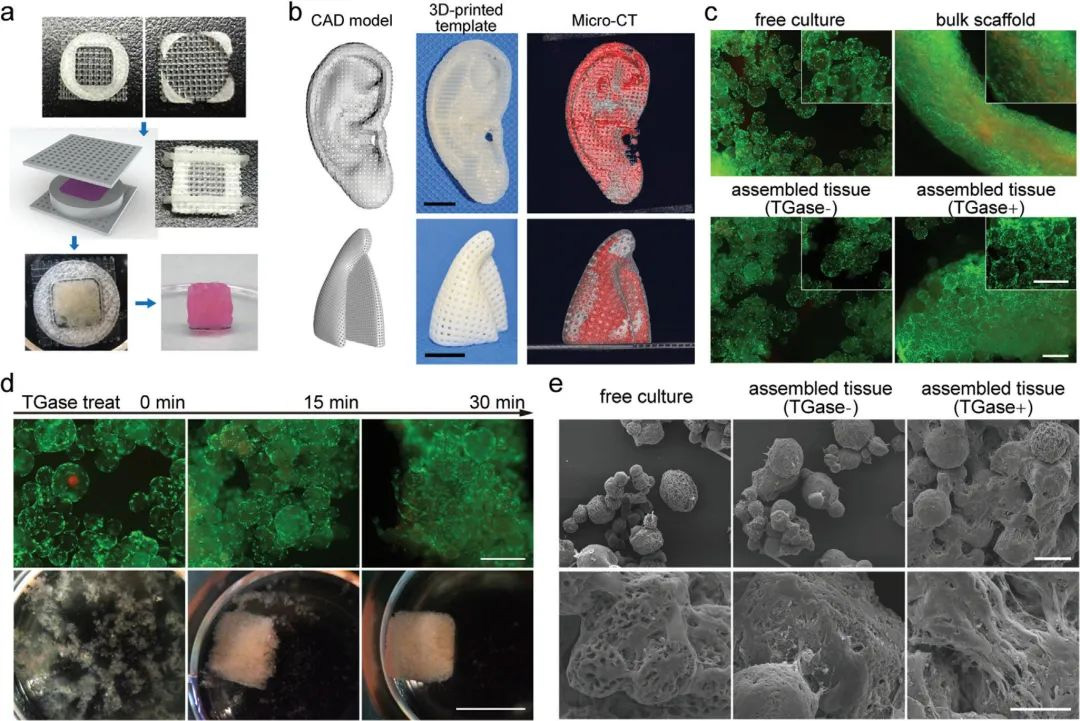
图3 TGase酶促微球组装和体外培养
体内植入评价
MSC微组织的存在显著减弱了皮下植入的免疫排斥反应,而在不含MSC微组织的支架则形成了明显的纤维囊。进一步,为了促进移植后的组织存活,采用皮瓣预制方法,即结扎了耳中央动静脉分支远端,在耳根处反转,并通过皮下隧道植入到前额,并放置在打印支架预留的孔道内。实验结果显示该方法可以促进宿主血管的长入,同时提高了组织强度,具有向软骨分化的潜能。
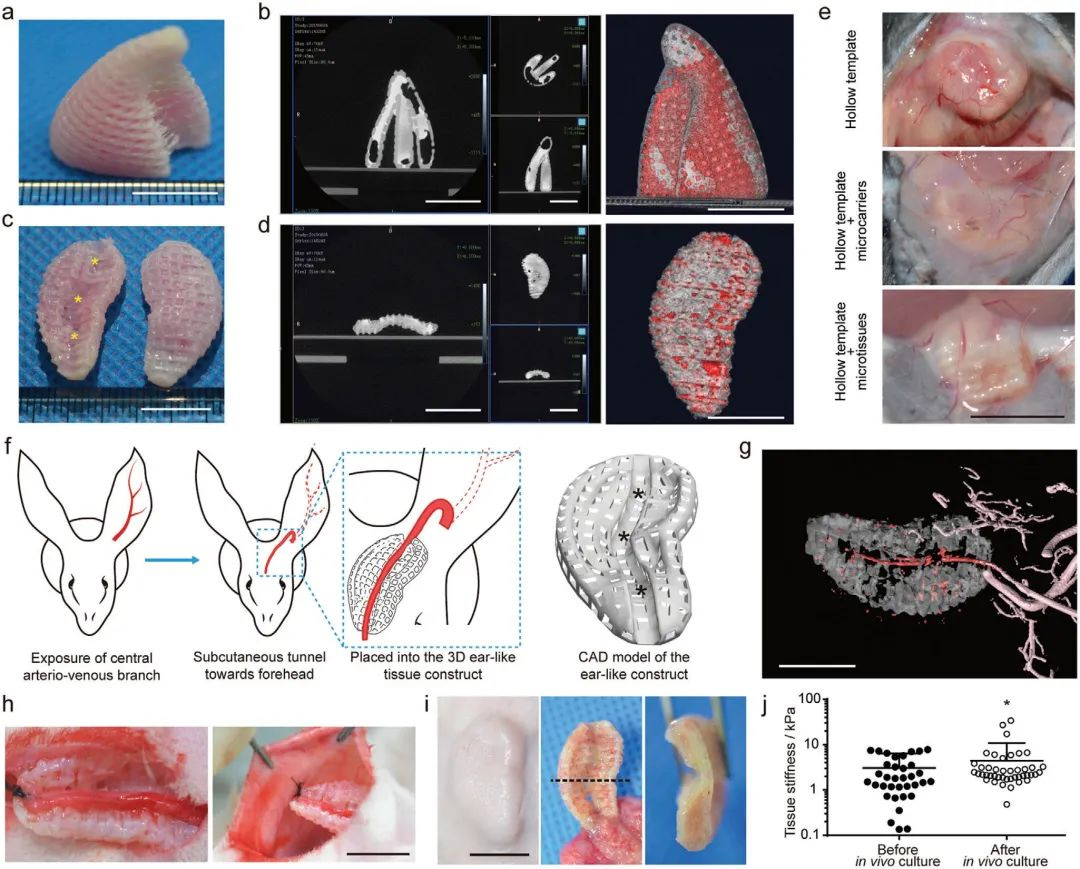
图4 3D-MAPS组织的体内移植与评价
总结
大尺度复杂组织的体外构建仍然是组织工程领域中的重要挑战之一。本研究提出了一种将“自下而上”的模块化组装技术(Modular assembly)与3D打印相结合的策略,其具有大尺度、复杂结构、高精度和高细胞活性等优点,促进了工程化组织在再生治疗领域中的应用。
参考文献
Yu, H., et al., TGase‐Enhanced Microtissue Assembly in 3D‐Printed‐Template‐Scaffold (3D‐MAPS) for Large Tissue Defect Reparation. Advanced Healthcare Materials, 2020. 9(18): p. 2000531.(https://doi.org/10.1002/adhm.202000531)
Scan the QR code to read on your phone
Latest News
-
Phone
- Service hotline+86 400-012-6688
-
E-mail
- E-mailwangal@cytoniche.com
- TOP



 京公网安备 11010802037749号
京公网安备 11010802037749号
